高浓度含铬电镀废水主要来源于废镀液和镀件清洗水,其中含有大量Cr(Ⅵ),若处理不当将严重威胁生态环境。据了解,目前国内很多中、小型电镀厂都采用最简单的化学还原法处理高浓度含铬废水,产生大量含铬污泥,极易造成二次污染,且需高价转到有资质的固废处理单位进行无害化处理,造成大量人力、物力的浪费,并不可取。
笔者以青岛某电子公司产生的高浓度含铬电镀废水为研究对象,探讨其资源化、无害化处理途径,采用回收铬黄和铁氧体处理相结合的方法,回收废水中的铬,使废水达到国家排放标准要求。此方法可将污泥量及其二次污染可能性尽可能地降低。
1 实验部分
1.1 废水来源及性质
该含铬电镀废水取自青岛某电子公司电镀车间,主要来源于铬电镀废液和镀件清洗水,为强酸性高浓度含铬废水,并含有大量硫酸根离子和少量铁离子,废水出水量约1.639 t/d。测得该废水水质为:总铬5.078 g/L、Cr(Ⅵ)4.303 g/L、SO42- 4.44 g/L、总铁357.5 mg/L、色度45 000 倍、pH=1.0。可以看出该废水酸性极强,色度高(不透明)且铬浓度高,若采用普通的化学法处理会造成金属铬的浪费,并产生大量污泥;采用生物法则负荷过大。因此笔者采用先回收、后处理的方法对废水进行资源化处理,既节约了资源又消除了污染。
1.2 实验仪器及试剂
仪器:T6 紫外可见分光光度计(北京普析通用仪器有限公司);85-2 恒温磁力搅拌器(常州国华电器有限公司);HDM-500 恒温电热套(常州国华电器有限公司);202-2AB 电热恒温干燥箱(天津市泰斯特仪器有限公司);pHS-2F pH 计(上海精密科学仪器有限公司);ALC-1100.2 型Acculab 电子天平(赛多利斯科学仪器北京有限公司)。
试剂:过氧化氢(质量分数30%)、*********、氢氧化钠、硫酸亚铁、氯化铁、二苯基碳酰二肼、重铬酸钾、浓硫酸、磷酸、高锰酸钾、盐酸、碘化钾、硫代硫酸钠,均为分析纯。
1.3 实验方法
实验分3 个阶段进行:(1)除杂、氧化阶段,除去废水中的杂质金属离子并将三价铬氧化成六价铬;(2)合成铬黄;(3)铁氧体法后处理,进一步除去残余铅、铬离子,确保废水达标。实验流程如图1所示。

图1 实验流程
1.4 分析方法
六价铬采用二苯碳酰二肼分光光度法测定;总铬采用高锰酸钾氧化-二苯碳酰二肼分光光度法测定;总铁采用邻菲啰啉分光光度法测定;总铅采用火焰原子分光光度法测定;色度采用稀释倍数法〔1〕测定。铅铬黄中的铬酸铅采用GB/T 3184—1993 硫代硫酸钠标准滴定法测定。
2 结果与讨论
2.1 除杂、氧化阶段
除杂、氧化目的是除去影响下一阶段合成铬黄的杂质,使除铬之外的金属离子生成沉淀而被分离,同时用过量H2O2使三价铬氧化为六价铬,提高铬的回收率。选择初始pH、反应时间、温度为考察因素,采用三因素三水平正交实验,以三价铬转化率为评价指标,确定各影响因素的主次关系:pH>反应温度>反应时间。为确定最佳反应条件,进行单因素优化实验。
2.1.1初始pH 对Cr(Ⅲ)转化率的影响
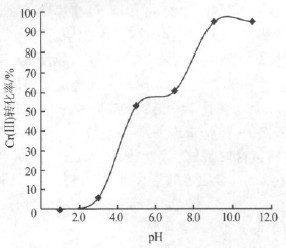
取一定量废水于6 个烧杯中,调节pH 分别为1.0、3.0、5.0、7.0、9.0、11.0,加入双氧水10 mL/L,在一定温度及氧化时间下,考察初始pH 对废水中Cr(Ⅲ)转化率的影响,结果如图2 所示。
图2 初始pH 对废水中Cr(Ⅲ)转化率的影响
由图2 可见,随着废水初始pH 的增加,Cr(Ⅲ)的转化率提高;当pH>9.0 时可达95%以上,说明碱性条件下过氧化氢易将Cr(Ⅲ)氧化。综合考虑,选定除杂、氧化阶段废水初始pH 为9.0。
2.1.2反应温度对Cr(Ⅲ)转化率的影响
取一定量废水,调节pH 为9.0,分别倒入7 个烧杯,加入双氧水10 mL/L,调节反应温度分别为20(不加热)、30、40、50、60、70、80℃,氧化时间60 min,考察反应温度对Cr(Ⅲ)转化率的影响,结果见图3。
由图3 可见,随着温度的升高,废水中Cr(Ⅲ)的转化率大幅提高;当反应温度为70 ℃时,转化率最高,之后呈下降趋势,因此选定除杂、氧化阶段反应温度为70 ℃。
2.1.3反应时间对Cr(Ⅲ)转化率的影响
取一定量废水,调节pH 为9.0,分别倒入6 个烧杯,加入双氧水10 mL/L,调节反应温度70 ℃,氧化时间分别为15、30、45、60、90、120 min,考察反应时间对Cr(Ⅲ)转化率的影响。
实验结果表明,随着时间的延长,废水中Cr(Ⅲ)的转化率大幅提高,30 min 后随反应时间延长Cr(Ⅲ)转化率提高缓慢,60 min 时Cr(Ⅲ)转化率达95.15%。综合考虑,选定除杂、氧化阶段反应时间为60 min。
综上得到除杂、氧化阶段的最佳反应条件:初始pH=9.0,反应温度70 ℃,氧化时间60 min。在此条件下,废水中Cr(Ⅲ)的转化率最高可达95.23%。
2.2 铬黄合成阶段
将除杂、氧化后的废水过滤,得到制备铅铬黄的母液(pH 约8.5)。取适量母液,调节pH 后加入过量Pb(NO3)2,过滤,得到铬黄。
2.2.1母液pH 的影响
分别取母液100 mL 于6 个烧杯中,调节其pH 分别为5.0、6.0、7.0、8.0、9.0、10.0,加入过量Pb(NO3)2,在60 ℃下反应10 min。实验结果见表1。
表1 母液pH 的影响
从表1 可见,随着pH 的增加,铬的回收率逐渐增大,铬黄质量和PbCrO4质量分数也逐渐提高,但碱性过大时有所下降。因此将母液pH 调整至9.0。
2.2.2 Pb(NO3)2添加量的影响
分别取母液100 mL 于6 个烧杯中,调节其pH为9.0,加入不同质量的Pb(NO3)2,在60 ℃下反应10 min。实验结果见表2。
表2 Pb(NO3)2添加量的影响

废水中的SO42-完全生成PbSO4沉淀所需Pb (NO3)2的理论质量是1.52 g,CrO42 -完全生成PbCrO4沉淀需Pb(NO3)2的理论质量是3.10 g。SO42-和CrO42-同时与Pb2+发生反应。因此,要使铬的回收率达到100%,Pb(NO3)2添加量需足够使2 种离子完全反应,但不能过量太多,否则会残余较多的Pb2+。实验得出Pb(NO3)2最佳添加量为5.26 g。具体参见http://www.dowater.com更多相关技术文档。
2.2.3反应温度的影响
分别取母液100 mL 于10 个烧杯中,调节其pH为9.0,加入Pb(NO3)2 5.26 g,分别调节反应温度为20 (室温)、40、45、50、55、60、65、70、75、80 ℃,测定滤液中Cr(Ⅵ)和Pb2+的浓度,结果见图4。

图4 反应温度的影响
温度主要影响反应速率和铬酸铅的溶解度。在较低温度下,铬与铅反应不充分,滤液中残余的铬、铅离子浓度很高,铬回收率低;60 ℃左右时反应完全,滤液中的铬、铅离子浓度最低,铬回收率达到100%;但当温度升高至70 ℃以上时,铬酸铅的溶解度增大,滤液中铬、铅离子的浓度增加,且铅比铬升高快。因此将铬黄合成反应温度控制在60 ℃。
综上,合成铬黄阶段的最佳反应条件(母液100 mL):初始pH=9.0,Pb(NO3)2添加量5.26 g,反应温度60 ℃。得到产品铬黄4.96 g,PbCrO4质量分数为72.08%,铬回收率达100%。
2.3 铁氧体法后处理阶段
铁氧体法是日本电气公司首先提出的一种处理含重金属离子废水方法〔2〕。从效果与成本来看,铁氧体法较理想实用,因此在工业废水处理中得到广泛应用〔3〕。铁氧体法在处理含铬电镀废水、含铅废水中已有研究。金焰等〔4〕在常温下对模拟含铅废水进行处理,在pH=8、投料比为2 的最佳条件下,对0~400mg/L 含铅废水的去除率达99%以上。
用铁氧体法处理滤液,可除去铅离子及因反应不稳定而存在的铬离子。取多次反应后的滤液进行混合,其铅离子为20.35 mg/L,六价铬0.077 6 mg/L。取50 mL 该滤液,加入0.01 mol/L FeSO4溶液1.2 mL、0.01 mol/L FeCl3溶液2.0 mL,搅拌10 min,调节pH为10 左右,加热搅拌产生黑褐色沉淀,10 min 后沉淀完全。测定上清液,其中铅离子为0.10 mg/L,六价铬为0.038 2 mg/L,低于GB 21900—2008 中的污染物排放限值(六价铬0.2 mg/L,总铅0.2 mg/L)。
3 结论
(1)除杂、氧化的最佳反应条件:初始pH=9.0,反应温度70 ℃,双氧水10 mL/L,氧化时间60 min。最优条件下,废水中三价铬的转化率最高可达95.23%。
(2)合成铬黄的最佳反应条件:初始pH=9.0,*********添加量52.6 g/L,反应温度60 ℃。铬回收率达100%,所得产品铬黄中PbCrO4质量分数为72.08%,符合GB/T 3184—1993 中铬黄的技术要求。
(3)用铁氧体法处理铬黄合成反应后的滤液,出水中铅离子为0.10 mg/L,六价铬为0.038 2 mg/L,低于GB21900—2008 的污染物排放限值。
上一篇:有色金属工业废水处理技术
下一篇:含镍废水的处理工艺—反渗透膜技术